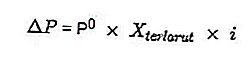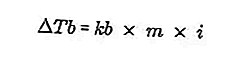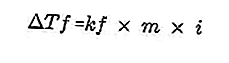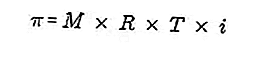Cuba perhatikan apa yang ada di sekitar kita yang berkaitan dengan kimia? Yang paling mudah adalah udara yang kita hirup, yang mengandungi campuran oksigen, nitrogen dan gas lain. Perasa makanan, pewarna makanan, dan pengawet makanan juga merupakan contoh bahan kimia lain yang ada di sekitar kita. Kimia adalah cabang sains semula jadi yang akan anda pelajari di sekolah yang mengkaji pelbagai bahan, salah satu contohnya adalah struktur jirim, sifat jirim, bentuk bahan, perubahan jirim, klasifikasi jirim, komposisi jirim dan tenaga yang menyertai perubahan ini. Bukan hanya matematik dan fizik, kimia juga mempunyai pelbagai jenis formula, anda tahu. Terdapat banyak formula kimia yang akan anda pelajari, dari sifat koligatif hingga tindak balas redoks.
Pada kesempatan ini kami akan mempelajari pelbagai formula kimia dan juga contoh masalahnya yang akan membantu anda memahami konsep formula kimia.
Rumus Kimia dan Masalah Contoh
Kehadiran formula dalam kimia adalah untuk membantu penyelidik mencari pelbagai jenis hasil eksperimen yang akan dijalankan. Untuk dapat menguasai sains ini dengan baik, anda mesti mengetahui beberapa formula kimia yang sering anda hadapi semasa belajar kimia.
Formula untuk Penyelesaian Bersama Kolaboratif
Sifat koligatif larutan adalah ciri larutan yang tidak bergantung pada jenis bahan larut tetapi hanya bergantung pada kepekatan zarah larutan. Maka sifat koligatif larutan terdiri daripada dua jenis sifat, iaitu sifat koligatif larutan elektrolit dan sifat koligatif larutan bukan elektrolit.
- Sifat Kolaboratif Penyelesaian Bukan Elektrolit
Walaupun sifat koligatif melibatkan penyelesaian, sifat koligatif tidak bergantung pada interaksi molekul zat terlarut dan zat terlarut, tetapi dengan jumlah zat terlarut terlarut dalam larutan. Sifat koligatif terdiri daripada penurunan tekanan wap, peningkatan titik didih, penurunan titik beku, dan tekanan osmotik. Masing-masing memerlukan formula kimia untuk mendapatkan hasilnya.
- Persamaan penurunan tekanan wap

Sumber: formula.co.id
- Titik didih meningkatkan persamaan
Titik didih cecair adalah suhu tetap di mana ia mendidih. Pada suhu ini, tekanan wap cecair mempunyai persamaan tekanan udara di sekelilingnya dan disebabkan oleh penyejatan semua bahagian cecair. Titik didih cecair boleh diukur dengan tekanan 1 atmosfera.
Perbezaan titik didih larutan dan takat didih pelarut murni disebut kenaikan takat didih, persamaan untuk kenaikan takat didih adalah:

Sumber: formula.co.id
- Persamaan penurunan titik beku
Zat terlarut yang terdapat dalam larutan akan menjadikan titik beku larutan lebih kecil daripada titik beku pelarut. Persamaan pengurangan titik beku:

Sumber: formula.co.id
- Tekanan osmotik
Tekanan osmotik adalah daya yang diperlukan untuk mengimbangkan tekanan pelarut dari membran semipermiabel melalui larutan.
Membran semimermeabel adalah membran yang melaluinya molekul pelarut, tetapi zat terlarut tidak dapat melewati. Menurut Van't Hoff, pada tekanan osmotik penyelesaiannya dirumuskan seperti berikut:

Sumber: formula.co.id
- Sifat kolaboratif larutan elektrolit
Dalam kepekatan, sifat koligatif larutan elektrolit yang sama mempunyai nilai yang lebih besar apabila kita membandingkannya dengan sifat koligatif larutan bukan elektrolit. Kerana sebilangan besar zarah zat terlarut terhasil dari tindak balas pengionan larutan elektrolit yang telah dirumuskan dalam faktor Van't Hoff.
Pengiraan sifat kolagatif larutan elektrolit akan selalu dikalikan dengan faktor Van't Hoff seperti berikut:

Sumber: formula.co.id
Beberapa formula untuk sifat koligatif larutan elektrolit lain adalah:
- Turunkan tekanan wap
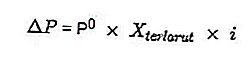
Sumber: formula.co.id
- Peningkatan takat didih
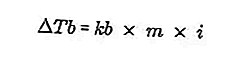
Sumber: formula.co.id
- Penurunan titik beku
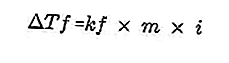
Sumber: formula.co.id
- Tekanan osmotik
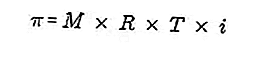
Sumber: formula.co.id
Rumus Molariti, Molaliti dan Pecahan Mol
Molariti (M)
Molariti ialah bilangan mol bahan yang dilarutkan dalam 1 liter larutan.

Sumber: formula.co.id
M = molariti
Mr = jisim molar zat terlarut (g / mol)
V = isi padu larutan
Moraliti (m)
Molality adalah bilangan mol bahan yang dilarutkan dalam 1 kg pelarut. Formula kimia adalah seperti berikut.

Sumber: formula.co.id
m = molaliti (mol / kg)
Mr = jisim molar zat terlarut (g / mol)
jisim = jisim zat terlarut (g)
P = jisim pelarut (g)
Pecahan mol
Fraksi mol adalah satu unit kepekatan di mana semua komponen larutan dikira berdasarkan tahi lalat.

Sumber: formula.co.id
xi = bilangan mol
i, j, xj = pecahan mol
Contoh masalah formula kimia
1. Sekiranya tekanan osmotik larutan fruktosa 500 ml, C6H12O6 dari 32 ° C ialah 2 atm, jisim fruktosa yang dilarutkan adalah?
Penyelesaian:

2. Dalam pecahan mol larutan urea di dalam air 0.2. Tekanan wap tepu air murni dengan suhu 20 ° C ialah 17.5 mmHg. Kemudian pada larutan tekanan wap tepu pada suhu berikut adalah?
X urea + X air = 1
0.2 + X air = 1
X air = 0.8
Penyelesaian P = air X x air
P larutan = 0.8 x 17.5 mmHg
P larutan = 14 mmHg
Itulah beberapa formula kimia yang boleh anda pelajari untuk memudahkan anda menjawab pelbagai jenis soalan kimia. Sekiranya anda merasakan formula ini tidak mencukupi, anda boleh mencuba produk MASALAH, penyelesaian praktik dalam talian yang berwajaran, lengkap untuk Kelas Pintar seperti Trigonometri, Had, Logaritma dan banyak lagi. Bermula dari peringkat sekolah rendah, sekolah menengah hingga sekolah menengah dengan pelbagai mata pelajaran seperti matematik, fizik, kimia dan lain-lain. Di sini anda dapat mempelajari pelbagai jenis formula lengkap dengan contoh masalahnya.
Ayuh, tunggu apa lagi! Mari cuba latihan MASALAH di Kelas Bestari sekarang