Dalam artikel sebelumnya kita membincangkan apa itu reaksi redoks. Reaksi redoks yang biasa digunakan dalam bidang farmasi, biologi, industri, metalurgi, dan pertanian adalah jenis reaksi pengoksidaan dan pengurangan yang berlaku secara serentak. Semasa tindak balas redoks, bilangan elektron yang hilang sama dengan bilangan elektron yang diperoleh.
Reaksi redoks terdiri daripada tindak balas pengurangan dan pengoksidaan. Pengurangan adalah proses penyingkiran oksigen atau unsur elektronegatif dari suatu bahan atau penambahan hidrogen atau unsur elektropositif pada suatu bahan. Sementara itu, pengoksidaan adalah penambahan oksigen atau unsur elektronegatif ke suatu bahan atau penyingkiran hidrogen atau unsur elektropositif dari suatu bahan.
Terdapat beberapa jenis reaksi redoks yang kita kenal, termasuk reaksi gabungan, penguraian, pertukaran, dan ketidakseimbangan.
Reaksi Gabungan
Reaksi gabungan adalah tindak balas apabila dua atau lebih unsur bergabung untuk membentuk sebatian tunggal.
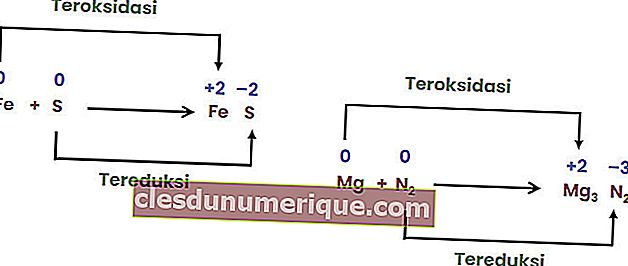
Tindakbalas Penguraian
Reaksi penguraian atau penguraian adalah tindak balas apabila suatu sebatian pecah atau terbahagi kepada dua atau lebih unsur atau unsur sederhana. Reaksi penguraian biasanya disebut sebagai kebalikan dari tindak balas gabungan.
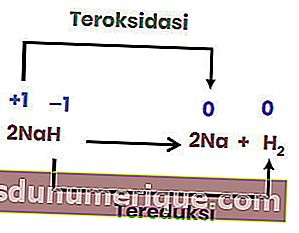
Walau bagaimanapun, tidak semua reaksi penguraian adalah reaksi redoks. Contohnya ialah reaksi berikut.
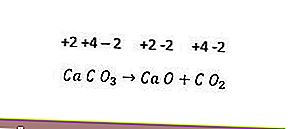
Oleh kerana tidak ada perubahan dalam bilangan pengoksidaan setiap unsur, tindak balas di atas bukanlah tindak balas redoks. Agar tindak balas penguraian menjadi tindak balas redoks, sekurang-kurangnya salah satu komponen yang terbentuk mestilah dalam bentuk unsur.
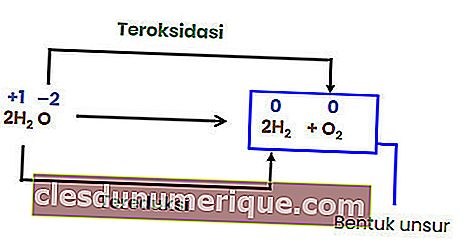
Tindak Balas Pertukaran
Reaksi pertukaran atau penggantian adalah reaksi di mana atom atau ion dalam sebatian digantikan oleh atom atau ion dari sebatian lain. Reaksi penggantian dikelaskan kepada penggantian logam dan bukan logam.
(Baca juga: Ketahui Tentang Reaksi Redoks)
Penggantian logam berlaku apabila logam dalam sebatian digantikan oleh logam yang lebih reaktif dalam keadaan bebas. Contohnya ialah reaksi di bawah.

Reaksi penggantian logam berguna dalam proses metalurgi apabila logam tulen diperoleh dari sebatian yang terdapat dalam bijih.
Sementara itu, reaksi penggantian bukan logam termasuk penggantian hidrogen, halogen, dan kadang-kadang oksigen. Semua logam alkali dan beberapa logam bumi alkali (Ca, Sr, dan Ba) menggantikan hidrogen dari air sejuk. Contohnya dapat dilihat pada reaksi berikut.
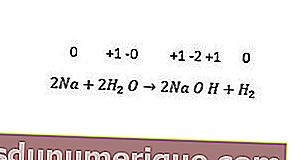
Reaksi tidak seimbang
Jenis tindak balas redoks terakhir adalah tidak seimbang. Reaksi ini berlaku apabila unsur yang sama secara serentak dioksidakan dan dikurangkan. Unsur yang mempunyai tiga atau lebih nombor pengoksidaan boleh bertindak sebagai agen pengoksidaan dan agen pengurangannya sendiri. Contohnya ialah reaksi berikut.
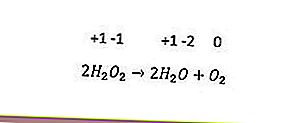
Dalam tindak balas di atas, nombor pengoksidaan oksigen (-1) dikurangkan menjadi -2 dan dioksidakan menjadi 0.









